近日,生物催化与分子诊断团队在国际高水平期刊ACS Catalysis上在线发表了题为“Extending the substrate scope of an ω‑amine transaminase from Aspergillus terreus by reconstructing and engineering an ancestral enzyme”的论文(点击阅读)。生化学院2023届硕士研究生蔡婷婷为论文第一作者,黄俊教授、邱帅副教授与河南工业大学李娜副教授为论文通讯作者,浙江科技大学为第一单位。生化学院樊芳芳副教授对本工作的理论模拟部分提供指导。
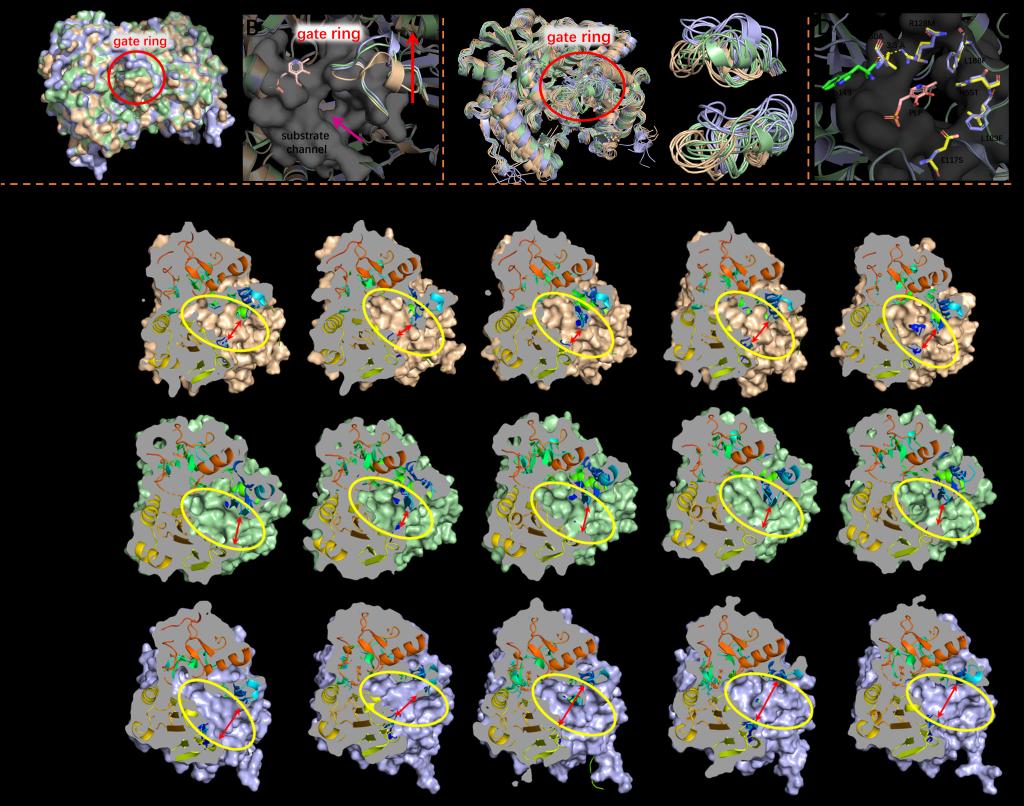
目前亟需开发具有更多高活性、高稳定性和广底物谱的转氨酶来适应工业生产的需要。本研究采用祖先序列重建-晶体结构导向-口袋工程(ASCP)策略,对土曲霉属来源的R-ω-ATA (AtATA)进行蛋白工程改造,以提高其热稳定性及对非天然底物的催化活性。通过祖先序列重建策略,获得了热稳定性显著提升的祖先酶Anc101,相比于AtATA,其半失活温度高了10.9oC,在45 oC的半衰期是AtATA的484倍。为提高Anc101对非天然底物的活性,通过解析Anc101的X射线晶体结构(PDB: 8ZM7),并以此结构为指导对底物结合口袋进行修饰。经过8轮迭代饱和突变,得到了对大体积底物3-乙酰联苯催化活性提高133倍的最佳突变体Anc1016 (Anc101-H55T-E117S-R128M-V150A-L183F-L188F)。与Anc101相比,Anc1016对14种非天然底物的转化率提高了2-87%。分子动力学结果表明,覆盖在Anc1016口袋入口的“门控环”比Anc101更灵活,从而增加了底物与结合口袋的接触;并且Anc1016的大底物结合口袋和小底物结合口袋的总体积也有所增加,这两种变化都有助于增强Anc1016对非天然底物的活性。
生物催化与分子诊断团队从事酶定向进化、酶催化机制研究、体外快速诊断等工作,迄今为止,多项研究成果已在Applied and Environmental Microbiology、Engineering、Biotechnology and Bioengineering等国际高水平期刊发表。本研究受到国家自然科学基金项目和浙江省高层次人才特殊支持计划项目的支持。(生化学院 付阳)

